Transferencia de electrones
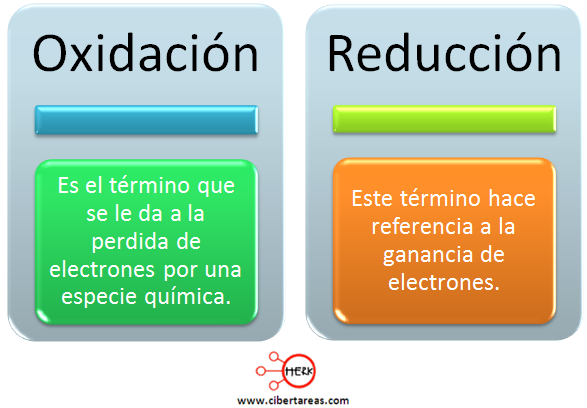
De esta nueva definición se deduce inmediatamente que no puede haber procesos de oxidación o de reducción aislados, porque si una especie química pierde electrones, otra debe ganarlos. Esto es lo que ocurre en los ejemplos anteriores: tanto el oxígeno como el halógeno ganan electrones (los cedidos por el metal) y se transforman en su respectivos aniones.
Por tanto, todo proceso de oxidación va unido necesariamente a otro de reducción. Se ha de hablar, pues, de reacciones de oxidación-reducción, de reacciones redox. En ellas hay una transferencia de electrones desde la sustancia que se oxida, perdiendo electrones, a la que se reduce, ganándolos.
Muchas veces es difícil deducir si una reacción es redox, especialmente cuando intervienen compuestos con enlaces covalentes. Por ejemplo, fíjate en la reacción Si + 2 Cl2 →SiCl4. No hay ni pérdida ni ganancia de electrones, puesto que se forman enlaces covalentes. Sin embargo los enlaces son polares, al ser un átomo mas electronegativo que otro, y por tanto hay una ganancia parcial de electrones por parte del elemento más electronegativo, a costa de una pérdida parcial por parte del elemento más electropositivo.
Para resolver el problema de qué átomos ganan o pierden electrones (total o parcialmente) se utilizan los llamados números de oxidación.
Para resolver el problema de qué átomos ganan o pierden electrones (total o parcialmente) se utilizan los llamados números de oxidación.


No hay comentarios:
Publicar un comentario